
quinta-feira, 10 de junho de 2010
O responsável por colocar ordem nos elementos da tabela periódica
Tabela periódica em forma de galáxia


Essa é a mais recente tentativa de elaborar uma nova tabela e que vem sendo apreciada em vários setores científicos pela beleza e funcionalidade, notadamente na Grã-Bretanha, onde surgiu. Ainda se inspira no Parafuso Telúrico, de Chancourtois. Foi idealizada pelo professor de Biologia da Universidade de Oxford, na Inglaterra, Philip Stewart. Procura adicionar beleza ao atual modelo e estimular a imaginação do leitor com uma alusão à sua semelhança a uma galáxia, vez que a espiral sobre a qual se monta é infinita, porque prevê a inclusão de um número desconhecido de elementos a serem descobertos e dá a idéia de movimento no espaço, já que a atividade atômica não é estática e se assemelha a um microcosmo, conforme as partículas já descobertas têm demonstrado,quando observadas em poderosos microscópios eletrônicos ( tais como prótons, elétrons, nêutrons, quarks, fótons ), e a existência de órbitas elípticas e movimentos de rotação em torno de eixos próprios , ou spin. Suas inovações :
1) O modelo é todo circular : Stewart colocou os elementos em pequenos círculos e, ligados a eles, outros, menores, com os números atômicos correspondentes a cada elemento. Segundo ele, “ O cérebro humano se sente mais confortável com curvas do que com retas”. Mas conservou as cores originais das famílias dos elementos químicos.
2) O Hidrogênio (H), que na Tabela de Mendeleiev fica perto dos metais alcalinos, ganhou nova posição, na espiral - fica colocado em um aro mais central, perto do Carbono (C) , justificando essa alteração pelo fato de haver mais afinidade entre o Hidrogênio e o Carbono, com quem faz ligações com mais facilidade, do que entre o Hidrogênio e o lítio (Li) , e os metais alcalinos.
3) No centro dos círculos em espiral, foi colocado um elemento cuja existência está prevista pelos cientistas, embora ainda não confirmada, e que seria o Neutrônio, também conhecido como “Elemento Zero”, pois, por hipótese, possuiria apenas nêutrons em seu núcleo.
** “EM OUTRO LUGAR . Na tabela, o hidrogênio (H) ficava perto dos metais alcalinos, como o lítio (Li) . Na espiral, ele ganhou uma posição nova e isolada, mais próxima do carbono (C), com o qual ele tem mais semelhanças e freqüentemente se combina.
quarta-feira, 9 de junho de 2010
terça-feira, 8 de junho de 2010
sexta-feira, 4 de junho de 2010
Reações Inorgânicas e Tabela de Solubilidade

1) Reação entre ácido clorídrico e nitrato de prata dando precipitado branco de cloreto de prata.
HCl + AgNO3 → AgCl + HNO3
2) O precipitado de cloreto de prata escurece quando exposto à luz. Prata finamente dividida é preta.
2AgCl 2Ag + Cl2
3) Reação de ácido clorídrico com zinco liberando gás hidrogênio (efervescência)
Zn + 2HCl → ZnCl2 + H2
4) Reação entre sulfato de cobre e hidróxido de sódio dando precipitado azul de hidróxido de cobre.
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
5) Formação de precipitado verde de hidróxido de ferro II na reação de sulfato de ferro II com hidróxido de sódio.
FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2
6) Precipitado vermelho ferrugem de hidróxido de ferro III formado na reação de sulfato de ferro III com hidróxido de sódio.
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3
TABELA DE SOLUBILIDADE

Principais Ácidos e Fórmulas moleculares
HF Ácido fluorídrico
HCl Ácido clorídrico
HBr Ácido bromídrico
HI Ácido iodídrico
H2S Ácido sulfídrico
HCN Ácido cianídrico
HNO3 Ácido nítrico
HNO2 Ácido nitroso
H2SO4 Ácido sulfúrico
H2SO3 Ácido sulfuroso
H2CO3 Ácido carbônico
H3PO4 Ácido fosfórico (Ortofosfórico)
H3PO3 Ácido fosforoso
H3PO2 Ácido hipofosforoso
HPO3 Ácido metafosfórico
H4P2O7 Ácido pirofosfórico
HClO Ácido hipocloroso
HClO2 Ácido cloroso
HClO3 Ácido clórico
HClO4 Ácido perclórico
H3BO3 Ácido bórico
HMnO4 Ácido permangânico
H2Cr2O7 Ácido dicrômico
H3C – COOH Ácido acético (etanóico)
Tabela de Cátions e Ânions
+1 (Monopositivos)
Li Lítio
Na Sódio
K Potássio
Rb Rubídio
Cs Césio
Ag Prata
NH4 Amônio
H3O Hidroxônio (Hidrônio)
+2 (Dipositivos)
Be Berílio
Mg Magnésio
Ca Cálcio
Sr Estrôncio
Ba Bário
Ra Rádio
Zn Zinco
+3 (Tripositivos)
Al Alumínio
+1 e +2 (Mono e Dipositivos)
Cu Cobre
Hg Mercúrio
+2 e +3 (Di e Tripositivos)
Fe Ferro
Co Cobalto
Ni Níquel
+1 e +3 (Mono e Tripositivos)
Au Ouro
+2 e +4 (Di e Tetrapositivos)
Sn Estanho
Pb Chumbo
Pt Platina
TABELA DE ÂNIONS
Monovalentes (–1)
Cl Cloreto
Br Brometo
I Iodeto
F Fluoreto
ClO Hipoclorito
ClO2 Clorato
ClO3 Clorato
ClO4 Perclorato
BrO Hipobromito
BrO2 Bromito
BrO3 Bromato
IO Hipoiodito
IO3 Iodato
IO4 Periodato
NO2 Nitrito
NO3 Nitrato
N3 Azoteto
NH2 Amideto
CN Cianeto
OCN Cianato
NCO Isocianato
ONC Fulminato
SCN Tiocianato
PO3 Metafosfato
H2PO2 Hipofosfito
MnO4 Permanganato
CH3COO Etanoato (acetato)
OH Hidróxido
[Al(OH)4] Tetraidroxialuminato
H Hidreto
O2 Superóxido
HS Hidrogenossulfeto
HSO3 Hidrogenossulfito ou sulfito ácido ou bissulfito
HSO4 Hidrogenossulfato ou sulfato ácido ou bissulfato
HCO3 Hidrogenocarbonato ou bicarbonato ou carbonato ácido
H2PO4 Diidrogenofosfato ou fosfato diácido
Bivalentes (– 2)
S Sulfeto
SO3 Sulfito
SO4 Sulfato
S2O7 Pirossulfato
HPO3 Fosfito
SiO3 Metassilicato
CrO4 Cromato
Cr2O7 Dicromato
O Óxido
O2 Peróxido
[Zn(OH)4] Tetraidroxizincato
[PtCl6] Hexacloroplatinato
HPO4 Hidrogenofosfato ou fosfato ácido
Trivalentes (– 3)
N Nitreto
PO4 Ortofosfato (fosfato)
AsO4 Arsenato
[Fe(CN)6] Ferricianeto
Tetravalentes (– 4)
P2O7 Pirofosfato
SiO4 Ortossilicato
[Fe(CN)6] Ferrocianeto
Distribuição dos elétrons nos subníveis e nos orbitais e Classificação dos Elementos
1) Os orbitais devem ser preenchidos em ordem crescente de energia. Esta pode ser obtida seguindo as diagonais do Diagrama de Linus Pauling:

CLASSIFICAÇÃO DOS ELEMENTOS
1) Elementos representativos - último elétron preenche subnível s ou p (grupos A ou 1, 2, 13, 14, 15, 16, 17).
2) Elementos de transição - último elétron preenche subnível d (grupos B ou 3 a 12).
3) Elementos de transição interna - último elétron preenche subnível f (lantanídeos : 5f; actinídeos : 6f).
4) Gases nobres: He(1s²) e Ne, Ar, Kr, Xe, Rn (n s² n p6) - grupo O, VIII A ou 18).
terça-feira, 1 de junho de 2010
A Festa dos Elementos
Os elementos resolveram fazer uma festinha!!!!
Olha a confusão.... :)
Imagens da Tabela Periódica

Castelo de algodão e carbonato de cálcio
Esta bela foto é de um conjunto de piscinas termais, conhecido como Pamukkale, que significa castelo de algodão.A formação foi declarada em 1988 como Patrimônio Mundial da UNESCO, em conjunto com a antiga cidade de Hierapólis localizada perto da cidade de Denizli, na Turquia.As formações brancas são compostas principalmente de travertino, uma rocha rica em carbonato de cálcio.
 Cristais de bismuto – Um mundo de cores
Cristais de bismuto – Um mundo de cores
Certamente vocês verão por aqui muitas fotos de cristais de bismuto. A beleza das peças é cativante.Esta primeira imagem mostra um pouco da impressionante gama de cores que surgem na superfície do cristal. São resultado de uma fina camada de óxido formado na superfície.Estes cristais são comumente encontrados a venda pela internet.
A imagem foi indicada por Kentaro Mori. Veja mais na galeria de Alchemist-hp.

Ferro no Sol
A luz ultravioleta que é emitida pelo ferro ionizado 11 vezes quando em temperaturas de 2 milhões de graus centígrados foi usada para registrar a imagem acima do Sol em 22 de Setembro. A imagem foi captada pela câmara EIT a bordo da espaçonave SOHO, um observatório espacial que pode observar o Sol de forma ininterrupta. Ferro ionizado onze vezes é um ferro atômico com onze de seus elétrons arrancados. Estes elétrons são removidos pelas frenéticas colisões com outros átomos e elétrons que ocorrem as temperaturas extremas da coroa solar. Pelo fato dos elétrons serem carregados negativamente, o átomo de ferro resultante é altamente positivo.
Imagem original emhttp://www.nasaimages.org/luna/servlet/detail/NVA2~4~4~4419~104945:The-Iron-Sun
 Chaveiro com trítio
Chaveiro com trítio
Este belo chaveiro luminoso é cheio de trítio, isótopo radioativo do hidrogênio, representado por 3H. As partículas beta emitidas devido ao decaimento radioativo do gás trítio excitam os átomos de uma camada de fósforo e portanto, emitem um belo brilho verde, sendo este fenômeno conhecido como radioluminescência. O brilho permanecerá por no mínimo 10 anos (normalmente até mais, já que a meia-vida do trítio é de 12,32 anos).
Original disponível emhttp://www.flickr.com/photos/bionerd/2901855040/
 Potássio em água
Potássio em água
Ao ser colocado em água, o potássio reage violentamente.A produção de grande quantidade de hidrogênio gás e calor resulta em eventuais projeções de chama e explosões.A reação é perigosa e deve ser realizada com cuidado.2K + 2H2O => 2KOH + H2
Nesta imagem, a água tornou-se rosada devido à presença de fenolftaleína em solução, que demonstra a formação do KOH e o consequente pH básico do meio após a reação.
Qual o Elemento Químico mais abundante no Universo? E na Terra?
O hidrogênio está presente em 93% dos átomos do cosmo. Esse elemento químico tomou conta do Universo por causa da sua simplicidade: em um átomo de hidrogênio, há um único próton no núcleo, que, por sua vez, é rodeado por apenas um elétron. "Esses núcleos foram os primeiros a aparecer, menos de um milésimo de segundo após o Big Bang (a grande explosão que teria dado origem ao Universo)", diz o astrônomo Antonio Mário Magalhães, da USP. Os 7% dos átomos restantes espaço afora são praticamente todos de hélio. A soma dos outros elementos químicos conhecidos não chega nem perto de 1%. Na Terra, porém, a história é bem diferente. Nosso planeta é feito basicamente de elementos mais pesados, com muitos prótons no núcleo, coisa rara no resto do cosmo. O mais abundante por aqui é o oxigênio, que responde pela metade dos átomos do planeta. Em segundo lugar, vem o ferro e, em terceiro, o silício - todos eles elementos insignificantes na grande escala universal.
Ingredientes planetários
Três elementos químicos formam, juntos, mais de 80% dos átomos da Terra
49,78% - Oxigênio
Domina a superfície do planeta e está presente na água, em rochas e no ar
16,78% - Ferro
Principal elemento químico do núcleo da Terra
14,64% - Silício
ELEMEMENTO 117!!!
Em 7 de abril de 2010, no Instituto Conjunto de Pesquisa Nuclear em Dubna, Rússia, físicos (inclusive colaboradores do Laboratório Nacional Lawrence Livermore, nos EUA) anunciaram na segunda-feira a descoberta de um elemento químico superpesado, o de número 117 na tabela periódica.

Uma equipe internacional de cientistas da Rússsia e dos Estados Unidos, juntamente com dois laboratórios e duas Universidades, criaram o elemento mais recente, o número 117 que, assim como os números dos outros elementos da Tabela, representa a quantidade de prótons que ele possui. Todos os elementos acima do urânio, que possui 92 prótons, são considerados pesados e a maioria deles não pode ser encontrada na natureza.
Para obter o 117, os pesquisadores tiveram que usar outro elemento, também raro, chamado berkelium (97 prótons) que é fabricado em laboratório. Durante dois anos, equipes observaram o padrão de decaimento de berkelium radioativo após seu bombardeamento com íons de cálcio. O sucesso do experimento dependia da existência de equipamentos de detecção e também da produção de isótopos especiais.
Os seis átomos produzidos do novo elemento são muito instáveis, e tiveram vida de 78 milissegundos. Antes de ser incluído na tabela, no entanto, o elemento deve passar pela aprovação oficial da IUPAC (International Union of Pure and Applied Chemistry, ou União Internacional de Química Pura e Aplicada) - que analisa também outras descobertas e sua possível inclusão.
A descoberta contou com a participação de cientistas do Joint Institute of Nuclear Research (Dubna, Rússia), Research Institute for Advanced Reactors (Dimitrovgrad, Rússia), Lawrence Livermore National Laboratory, Oak Ridge National Laboratory, Universidade Vanderbilt e Universidade de Nevada, nos Estados Unidos.
“ A descoberta do elemento 117 é o culminar de uma jornada de uma década com o objetivo de expendir a tabela periódica e escrever o próximo capítulo em pesquisa de elementos pesados” afirma o Acadêmico Yuri Oganessian, líder científico do Laboratório de Reações Nucleares em Dubna, Rússia.
segunda-feira, 24 de maio de 2010
Os elementos químicos no cotidiano - o mercúrio, o chumbo e o meio ambiente
- Mercúrio (Hg)
Compostos de mercúrio nas águas residuais de indústrias, ao serem despejados em rios, lagos ou oceanos , podem se transformar em dimetil-mercurio (CH3-Hg-CH3) por meio da ação de certas bactérias presentes nesses locais. Peixes, algas e moluscos são capazes de concentrar em seus organismos quantidades significativas do dimetil-mercurio. Esse composto é solúvel nas gorduras e entra na cadeia alimentar, quando os animais contaminados são ingeridos. Compostos de mercúrio podem ser muito estáveis, permanecendo muito tempo no organismo dos seres vivos.
Sérias medidas que proíbem a descarga de mercúrio nos rios, lagos e oceanos foram adotadas em todo o mundo , porém muito será necessário para a limpeza de todas as águas.
- Chumbo (Pb)
O chumbo na sua forma metálixa (elemento chumbo, Pb) naõ é venenoso. Muitas pessoas conseguem viver anos e anos com balas de chumbo instaladas no corpo.
Já outrasm, que aspiram ou ingerem compostos deste metal, podem morrer de plumbismo (envenenamento por chumbo).
Compostos de chumbo eram antigamente usados como pigmentos em certos corantes. Sendo assim, muitas tintas contêm chumbo. Crianças, em especial as que moravam em casas pintadas com tinta a base de chumbo, corriam o risco de contrair o plumbismo, se colocassem farelos de tinta na boca.
Um brasileiro associado à descoberta de elemento químico
Num artigo escrito em uma revista alemã (Allgemeines Journal der Chemie) publicada em Leipzig, no ano de 1800, são descritos doze novos minerais por ele descobertos, realizando pesquisas na Escandinávia. Dentre esses minerais, destacam-se a petalita e o espodumênio, que na realidade são aluminossilicatos do elemento Lítio. Ao descrever esses minerais, José Bonifácio demonstrou que eles apresentavam características alcalinas.
Baseado nas observações feitas por José Bonifácio, Berzelius escreveu a Berthollet, relatando a constatação feita por seu aluno Arfwedson: nesses minerais havia de fato um novo elemento, com características alcalinas.
Finalmente, Davy, na Inglaterra, utilizou a técnica recém-descoberta do processo da eletrólise e isolou o novo elemento. a ele foi dado o nome de Lítio (do grego lithos, pedra).
a razão deste nome é pelo fato de que ja haviam sido descobertos dois outros elementos alcalinos, o sódio e o potássio, que foram obtidos a partir de plantas.
Aparentemente, o lítio interfere em mecanismos biológicos nos quais o íon magnésio estaria envolvido, mas a sua função específica no cérebro ainda é desconhecido.
Excesso de lítio no organismo pode levar à parada cardíaca e, consequentemente à morte do paciente.
domingo, 23 de maio de 2010
Humor em Química
Ametal.
Homem (Hm)
Mulher (Mu)
Aldeido Fenol(*1920 +1974)
Filho bastardo da ligação covalente de um gás nobre e uma substância pura, que não soube usar a tabelinha periódica. Aldeido Fenol ficou conhecido por seu temperamento explosivo, já que costumava provocar reações eletrolíticas sempre que alguns maus elementos, ou metais da pesada, como o trio Bismuto(Bi), Irídio(Ir) e Tálio(Ti), discordavam dele.
Empresário de sucesso, era conhecido como o "rei da segunda via" por causa da enorme quantidade de complexos de carbono que vendia em escritórios e repartições. Mas com o advento da xerox, Aldeido foi à bancarrota e conheceu a miséria.
Em situação deplorável, teve que se sujeitar a tudo, tendo, inclusive, entregado seu anel benzênico a diversos elementos, como os famigerados Paládio(Pd), Molibdênio(Mo) e Cádmio(Cd), que não dispensaram a oportunidade de meter-lhe o Ferro(Fe). Comenta-se que até o Titânio Arnaldo Antunes e o eterno craque rubro-negro Zinco estiveram naquele Cu(Cobre). O contato com metais de transição, que jamais desejaram uma ligação estável, fizeram de nosso saudoso Fenol, uma figura insípida, inodora e incolor. Aldeido vivia na maior água.
No início dos anos 70, enveredou pelo caminho das drogas, cheirando polímeros e fazendo uso de um acido de alto teor PH que tirava todos os seus neutrons de órbita. Desempregado, nas CNTP vivia em estado sólido, mas mesmo duro, Aldeído não conseguia abandonar o vício, queimando suas parcas economias ao vender as suas últimas propriedades químicas.
Numa triste tarde de outubro, Aldeido foi preso e levado para uma cadeia molecular de segurança máxima. Lá recebeu a pressão de um vapor, que havia lhe adiantado uns compostos orgânicos. Depois de uma acalorada (+ ou- 360 Fahreinheit) discussão, o marginal partiu para a violência e, usando sua massa molecular, trucidou o pobre Aldeido Fenol, que não teve tempo nem para uma simples reação iônica.
----
----
----
----
----
Se você não faz parte da solução então faz parte do precipitado!.
Dependentes químicos
De nada adiantou a família avisar essas pobres pessoas, elas mesmo assim insistiram seguir no submundo da química. Veja esses impressionantes relatos:
 | M.S.D. comenta a sua escolha"Não foi por falta de aviso, mas me perdi no mundo da química e agora sou dependente." |
 | D.R.T. já não encontra mais solução"Até os 17 anos tudo ia bem, mas os colegas me influenciaram, atualmente estou completamente dependente..." |
 | F.P. alerta "Tenham todos muito cuidado! Este é um caminho sem volta. Agora minha percepção de mundo está completamente alterada, não consigo mais ser a mesma pessoa de 10 anos atrás!" |
 | A.W. diz sensibilizada "Minha mãe sempre me avisou, mas agora é tarde demais!" |
OBS: O diálogo foi alterado para preservar a identidade dos entrevistados.
Síntese de moléculas antropomórficas
Um grupo de cientistas do departamento de química da Rice University, no Texas, criou moléculas com formas que lembram as humanas.
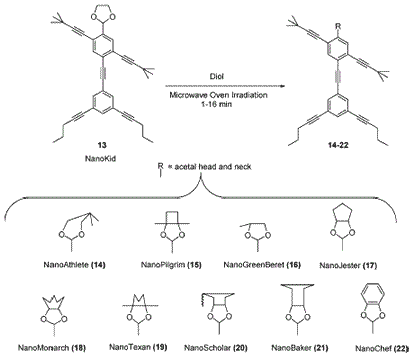
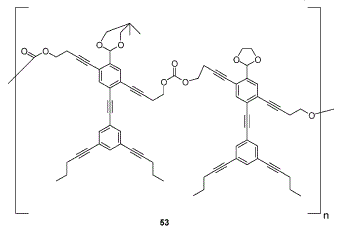
Os ´corpos´ são feitos de carbono e hidrogênio e os ´olhos´ são de oxigênio.
sexta-feira, 21 de maio de 2010
Jogo - Super Trunfo com Tabela Periódica
O que o aluno poderá aprender com esta aula compreender a Tabela Periódica e características de alguns elementos Duração das atividade.
Uma aula Conhecimentos prévios trabalhados pelo professor com o aluno.
Distribuição eletrônica; tabela periódica; propriedades periódicas. Estratégias e recursos da aula
Inspirados em diversos artigos e trabalhos (V. Recursos complementares), a proposta dessa aula é abordar de forma lúdica algumas informações sobre a Tabela Periódica e propriedades dos elementos químicos de forma a despertar a curiosidade nos alunos e agregar conhecimento.
1. As cartas devem conter o símbolo do elemento em tamanho maior e seu nome em tamanho menor, para chamar a atenção do aluno em relação ao símbolo, isto o ajudará a menorizar-los.
2. Nas cartas devem conter também características do elementos como: número atômico, massa atômica, eletronegatividade, raio atômico, elétrons na última camada, ponto de fusão, ponto de ebulição.
3. Se quiser deixa-lo mais atraente, coloque figuras de objetos relacionados ao elemento químico.
Em aula
1. Organize a turma em grupos de 2 a 4 alunos (desejável grupos de 4).
2.Distribua um baralho de "Super Trunfo da Tabela Periódica" para cada grupo e combine as regras do jogo.
Regras do Jogo
1. Sorteie no seu grupo quem começará a dar as cartas.
2. Após embaralhar, comece distribuindo as cartas pela sua direita. Uma de cada vez, até não restar mais cartas na sua mão.
3. Cada jogador deve empilhar na mão as cartas recebidas, viradas para si, cuidando para não mostrar para os colegas. Não vale trocar as cartas de lugar (elas devem ficar na mesma ordem que foram recebidas). Começa a jogar aquele que está a direita de quem deu as cartas.
4. O jogador que inicia a rodada deverá escolher uma das informações da primeira carta na sua mão e ler em voz alta seu valor (por exemplo, "raio atômico ") e colocá-la sobre a mesa. Todos os outros leem esta mesma informação em suas cartas e colocam sobre a mesa. Aquele que tiver jogado a carta de maior valor recolhe da mesa todas as cartas lidas e coloca no fim de seu monte. Se houver empate entre na rodada, os jogadores empatados devem disputar uma rodada entre si para ver quem levará tudo. Cantará o jogador à direita do que cantou na rodada de empate.
5. A vez da jogada agora é de quem recolheu as cartas. Ele lerá uma informação da próxima carta, repetindo-se a regra 4 e assim sucessivamente.
6. Vence a partida o jogador que conseguir ficar com todas as cartas dos colegas.
Comentários para o professor
1. Pode-se combinar outras regras com a turma para definir o vencedor. Exemplos:
a. o vencedor é aquele que tiver mais cartas na rodada em que o primeiro jogador perder sua última carta.
b. o vencedor é aquele que tiver mais cartas após XX minutos de jogo (o professor controla o tempo definido ou escolhe um tempo aleatório para dar suspense).
2. É recomendável que as cartas de cada rodada sejam colocadas sobre a mesa para que os todos observem as características dos elementos. O baralho usado como modelo também mostra uma figura em cada carta indicando um uso do elemento. É apenas uma informação ou curiosidade atraente, sem vínculo com o jogo em si.
3. Pode-se combinar um número de partidas durante a aula e pedir que os alunos anotem os nomes dos vencedores de cada rodada para entregar-lhe. Isso poderá lhe ser útil se desejar analisar pelo número de partidas, so jogo foi dinâmico; se algum jogador destacou-se no número de vitórias (melhor estrategista?, avalia melhor as propriedades dos elementos?, conhece mais a tabela?) e assim por diante.
4. As informações contidas no modelo sugerido são mais adequadas ao contexto do Ensino Médio (Química), no entanto, podem ser avaliadas outras informações que julgar mais adequadas ao Ensino Fundamental
Vídeo - O Alfabeto da Matéria
http://www.youtube.com/watch?v=x9kvrgZ_t-g
Vale a pena assistir,muito interessante esse vídeo.Na série "Mundos Invisíveis" do Fantástico, o físico Marcelo Gleiser vai contar a incrível história do cientista que organizou o alfabeto da matéria.
quinta-feira, 20 de maio de 2010
Departamento de Ciências Naturais

DCNAT
O Departamento de Ciências Naturais (DCNAT) da Universidade Federal de São João Del Rei – UFSJ foi criado em 05/10/1987, conforme portaria 251 do MEC, como um dos departamentos da então Fundação de Ensino Superior de São João Del Rei – FUNREI. Desde a sua criação, apresenta como característica básica a interdisciplinaridade entre as três áreas que congrega: Física, Química e Biologia. O Departamento oferece os seguintes cursos de graduação, Física, Química e Ciências Biológicas, nas modalidades: bacharelado e licenciatura.O DCNAT está localizado no campus Dom Bosco da UFSJ, ocupando uma área de aproximadamente 3800m2, a qual abrange laboratórios de ensino, pesquisa e extensão, salas de aula, salas de professores e laboratório de informática. O Departamento conta com 36 professores, dos quais 32 são doutores, 03 mestres e 01 com especialização.
Os docentes desenvolvem suas atividades em regime de dedicação exclusiva, responsabilizando-se pelas unidades curriculares de Biologia, Física e Química oferecidas nos cursos da UFSJ. Além das atividades de ensino, o desenvolvimento de projetos de pesquisas e de extensão, de caráter multi e interdisciplinar, têm, cada vez mais, acentuado a característica singular deste Departamento. Em linhas gerais, as atividades de pesquisa desenvolvidas no DCNAT envolvem caracterização de novos materiais, física experimental, mecânica estatística, teoria quântica de campos, física de partículas elementares, física do estado sólido, síntese e caracterização de materiais cerâmicos e poliméricos, química ambiental, educação científica, ecofisiologia, ecologia populacional, plantas medicinais e levantamento florístico. Dentre as atividades de extensão, a Central de Análises Químicas realiza análises de efluentes para diversas indústrias da região e o NPC, Núcleo de Professores de Ciências e Matemática da Região das Vertentes, atua, desde 1990, na formação continuada de professores da Educação Básica.

Universidade Federal de São João Del-Rei

Breve Histórico da UFSJ
A Universidade Federal de São João del-Rei - UFSJ originou-se das três instituições de ensino superior existentes em São João del-Rei na década de 1980: Faculdade Dom Bosco de Filosofia, Ciências e Letras; Faculdade de Ciências Econômicas, Administrativas e Contábeis; e Faculdade de Engenharia Industrial. É num contexto de resgate histórico que nasce a Fundação de Ensino Superior de São João del-Rei - FUNREI, após a assinatura da lei nº 7.555 de 18 de dezembro de 1986 pelo então Presidente José Sarney. Finalmente, em 19 de abril de 2002, a instituição é transformada em Universidade Federal, lei 10.425.
A UFSJ conta com três campi em São João del-Rei: Santo Antônio, Dom Bosco e Tancredo Neves, além de um Centro Cultural "Solar da Baronesa". Em São João Del-Rei são oferecidos os seguintes cursos de graduação: Administração (integral e noturno), Ciências Biológicas, Ciências Contábeis, Ciências Econômicas, Educação Física, Engenharia Industrial Elétrica (integral e noturno), Engenharia Industrial Mecânica (integral e noturno), Filosofia, Física, História, Letras, Matemática, Pedagogia, Psicologia (integral e noturno), Química e Música. Os cursos de Educação Física e Música são oferecidos exclusivamente em turno integral; os demais são de oferta exclusiva no turno noturno.
Ainda em São João del-Rei, a UFSJ oferece, em nível de Pós-Graduação Stricto Sensu, os cursos de Mestrado Interdisciplinar em Física, Química e Neurociências e Mestrado em Letras. Já a partir de 2008, serão oferecidos os cursos de Mestrado em: Educação; Psicologia; História; e Engenharia de Energia. Desde 1997, a Universidade Federal de São João del-Rei vem ofertando Cursos de Pós-Graduação Lato-Sensu - Especialização - em diversas áreas, a exemplo de Administração, Economia e Gestão de Agronegócios, Matemática, Filosofia e História.
Um quarto campus está em fase de implantação para atender ao projeto de expansão do governo federal, situado no Alto do Paraopeba na cidade de Ouro Branco e abrigando, a partir de 2008, cinco cursos de graduação na área de Engenharia: Engenharia Civil, Engenharia de Processos, Engenharia Mecatrônica, Engenharia de Telecomunicações e Engenharia Química. Mais um quinto campus está em implantação no município de Divinópolis, com quatro novos cursos a partir de 2008 na área de Saúde: Medicina, Farmácia, Enfermagem e Bioquímica.
Para o desenvolvimento do ensino, da pesquisa e da extensão, a UFSJ conta em junho de 2007 com um quadro constituído de 216 docentes efetivos e 236 técnico-administrativos. Mais docentes e técnicos-administrativos serão concursados para atuarem nos novos campi de Divinópolis e Alto Paraopeba.
O alto padrão de formação de seu quadro profissional aliado à oferta majoritária de cursos noturnos fazem da UFSJ uma instituição pública de alta qualidade e destacadamente inclusiva, com cerca de 70% de seus alunos de graduação sendo egressos de escolas públicas de ensino médio.


Tabela periódica

click na imagem para amplia-la
Histórico
Em 1829, Döbereiner reuniu os elementos semelhantes em grupos de três.
Cada grupo recebeu o nome de tríade. A massa atômica de um elemento era aproximadamente a média aritmética das massas atômicas dos dois outros elementos.
Exemplo:
Li = 7u
Na = 23u
K = 39u
Em 1863, Chancourtois dispôs os elementos os elementos numa espiral traçada nas paredes de um cilindro, em ordem crescente de massas atômicas. Tal classificação recebeu o nome de parafuso telúrico.
Já, em 1864, Newlands dispôs os elementos em colunas verticais de sete elementos, em ordem crescente de massas atômicas, observando que de sete em set elementos havia repetição das propriedades, fato que recebeu o nome de Lei das Oitavas.
Finalmente, em 1869, Mendeleev apresentou uma classificação, que é a base da classificação periódica moderna, colocando os elementos em ordem crescente de suas massas atômicas, distribuídos em oito faixas horizontais (períodos) e doze colunas verticais (famílias). Verificou que as propriedades variavam periodicamente à medida que aumentava a massa atômica.
Na tabela periódica moderna, os elementos são colocados em ordem crescente de número atômico.
Construção da Tabela Periódica
Os elementos são colocados em faixas horizontais (períodos) e faixas verticais (grupos ou famílias).
Em um grupo, os elementos têm propriedades semelhantes e, em um período, as propriedades são diferentes.
Na tabela há sete períodos.
Os grupos são numerados de 0 a 8. Com exceção dos grupos 0 e 8, cada grupo está subdividido em dois subgrupos, A e B. O grupo 8 é chamado de 8B e é constituído por três faixas verticais.
Modernamente, cada coluna é chamada de grupo. Há, portanto, 18 grupos numerados de 1 a 18.
Posição dos Elementos na Tabela Periódica
- Elementos representativos ou típicos (o último elétron é colocado em subnível s ou p): grupos A. Estão nos extremos da tabela.
- Elementos de transição (o último elétron é colocado em subnível d; apresentam subnível d incompleto): grupos 1B, 2B, 3B, 4B, 5B, 6B, 7B e 8B. Estão localizados no centro da tabela periódica.
- Elementos de transição interna (o último elétron é colocado em subnível f; apresentam subnível f incompleto). Estão divididos em duas classes:
– Lantanídeos (metais terras raras): grupo 3B e 6º período. Elementos de Z = 57 a 71.
– Actinídeos: grupo 3B e 7º período. Elementos de Z = 89 a 103.
- Gases nobres: grupo zero ou 8A ou 18.
Os grupos mais conhecidos são:
1A: metais alcalinos
2A: metais alcalinoterrosos
6A: calcogênios
7A: halogênios
Relação entre configuração eletrônica e a posição do elemento na tabela
Período:
Um elemento com x camadas eletrônicas está no período x.
Exemplo: P (Z = 15) K = 2 ; L = 8 ; M = 5
P (fósforo) está no 3º período.
Grupo:
a) Elementos representativos (grupos A) e 1B e 2B. O número de elétrons na camada de valência é o número do grupo.
Exemplo: P (Z =15) → K = 2 ; L = 8 ; M = 5
O fósforo está no grupo 5A.
b) Elementos de transição: a soma do número de elétrons dos subníveis s e d mais externos é o número do grupo. Exemplo: V (Z = 23)
1s2 2s2 2p6 3s2 3p6 4s2 3d3
Soma s + d = 2 + 3 = 5 → grupo 5B.



















